リスクコントロール
何事も「絶対に起こらない。」と言い切れない。
いまやリスクマネジメントプロセスは、品質マネジメントシステムに完全に統合するされることが望まれ、「受け入れ不可能なリスクのないこと」を目指します。
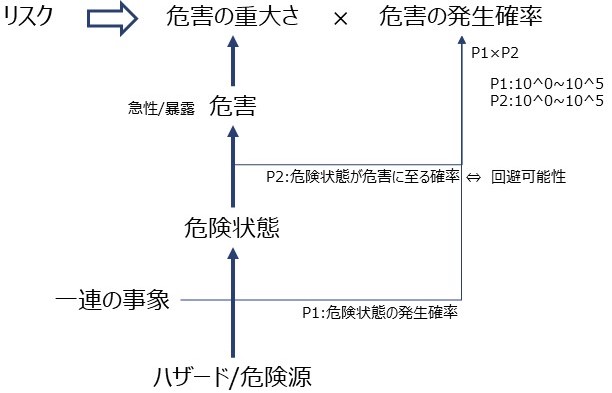
リスクの定義は、「危害の重大さと危害の発生確率の組み合わせ」です。
何事も「リスクを予想し、リスクの高い項目に関して重点管理を行う(リスク・ベースド)」これが求められています。
リスクコントロールは、すなわち、「危害の重大さを減ずる」、もしくは、「危害の発生確率を減ずる」ということです。
リスクリスクコントロールの方法は、ISO12100 JISB9700「3ステップメソッド」が明確でわかりやすいです。
「危害の重大さを減ずる」=「本質的安全設計方策」
1.本質的安全設計方策
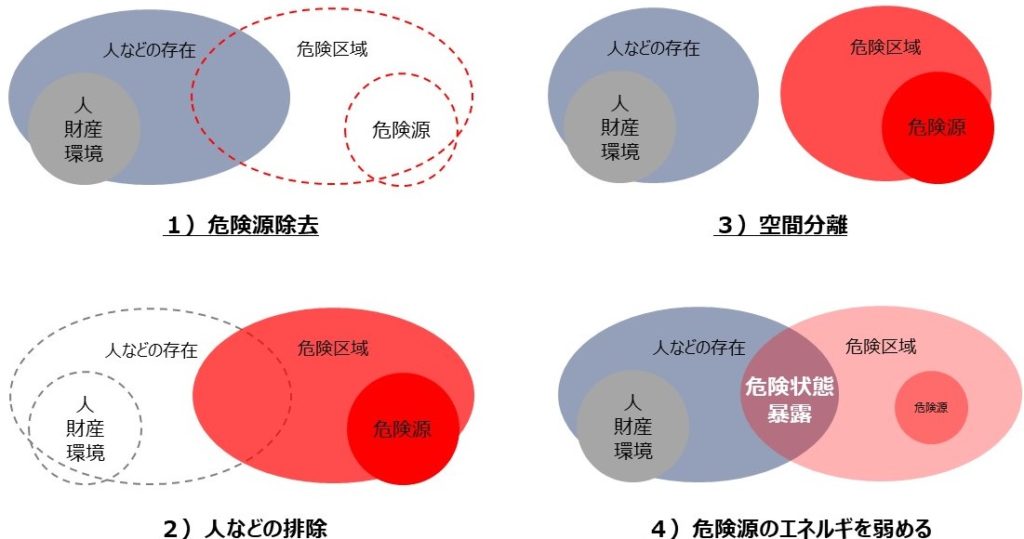
機械自体及び/又は機械と暴露される人との間の相互作用に関する設計特性を適切に選択することで、危険源を除去するか又はリスクを低減する
危険源を除去できる唯一の機会 ⇒ 危害の重大さ/発生確率を減らせるのはここだけ
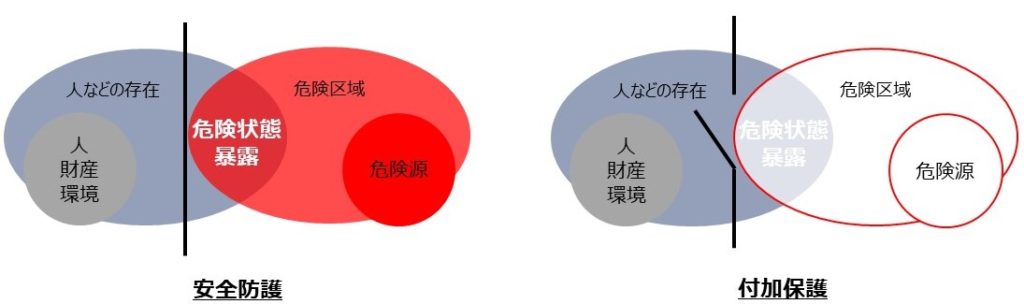
2.安全防護及び/又は付加保護方策
危険源を除去又はリスクを十分に低減することが本質的安全設計方策で実施できない場合、意図する使用及び合理的に予見可能な誤使用を考慮して適切に選択した安全防護及び付加保護方策を講じることで、リスクを低減する。
3.使用上の情報
本質的安全設計方策、安全防護及び付加保護方策の採用にもかかわらず、リスクを十分に低減できない場合、使用上の情報で残留リスクが認識されなければならない。
本質的安全設計方策 ISO12100 JISB9700
1)幾何学的要因及び物理的側面の考慮
幾何学的要因:死角の低減、すきま、鋭利、位置
物理的側面:作動力、運動エネルギ、騒音/振動/粉塵/放射
2)機械設計に関する一般技術知識の考慮
応力、材料、騒音/振動/粉塵/放射
3)適切な技術の選択
防爆/発火/騒音
4)ポジティブな機械的作用の原理の適用
稼働なものが剛体を介して他を必然的に動作させる(例:カムなど)
5)安定性に関する規定
重心/振動/基礎/風圧/人力
6)保全性に関する規定
接近性/取扱い/特殊工具
7)人間工学原則の遵守
ストレス/身体構造/温熱/リズム/照明/手動/視覚
8)電気的危険源
開閉/断路/感電
9)空圧及び液圧装置の危険源の防止
圧力(最大/変動/増加/喪失)、漏れ/噴出/暴れ、圧縮性
10)制御システムへの本質的安全設計方策の適用
コンピュータ化システムバリデーション
11)安全機能の故障の確率の最小化
非対称故障モード、冗長化
12)装置の信頼性による危険源への暴露制限
13)搬入又は搬出作業の機械化及び自動化による危険源への暴露制限
14)設定(段取り)及び保全の作業位置を危険区域外とすることによる危険源への暴露制限
この「本質的安全設計方策」の概念は、独立行政法人労働者健康安全機構 労働安全衛生総合研究所殿の以下ページが、非常にわかりやすいです。
https://www.jniosh.johas.go.jp/publication/mail_mag/2017/99-column-1.html
以下がその概念図です。
危険状態/暴露状態の概念
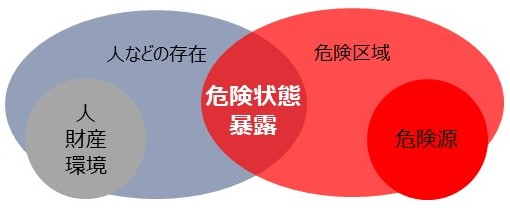
本質的安全設計方策の概念 危険状態を排除(減ずる)4つのパターン
安全防護及び/又は付加保護方策の概念
危害の発生確率は
P1:危険状態の発生確率
P2:危険状態が危害に至る確率⇔回避可能性
の関係で表します。
発生確率は10のべき乗、その乗数が危害の発生確率のレベルとしてあらわされている事が多いです。
リスクコントロールで一番困るのは、どうすれば「受け入れ不可能なリスクのないこと」と言えるのか。ということです。
これは、業界、社会情勢、国、常識などの影響があるため、一概に受容レベルは規定できません。
そんな中、発生確率に関して、日科技連の研究会で開発したリスクアセスメント R-Map(Risk-Map)に、発生頻度”0”の提言がされています。
https://www.meti.go.jp/product_safety/policy/riskhyouka.pdf
発生頻度”0”の目安
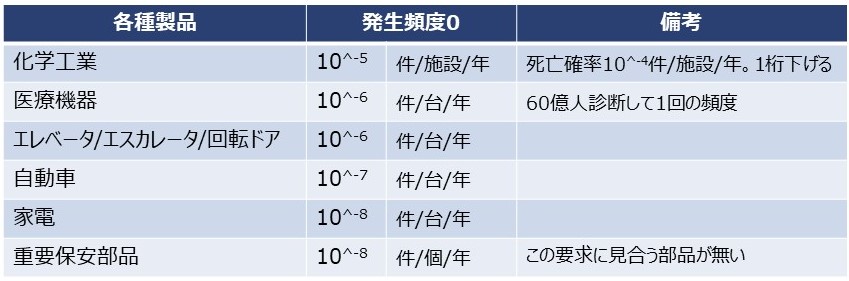
10^-8に見合う部品が無い場合には、これらの部品が壊れても事故を起こさないフェールセーフ、冗長化など、制御システムの本質的安全設計を行う。